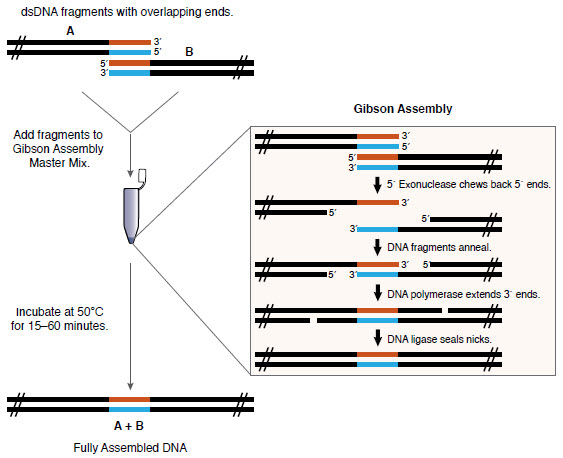
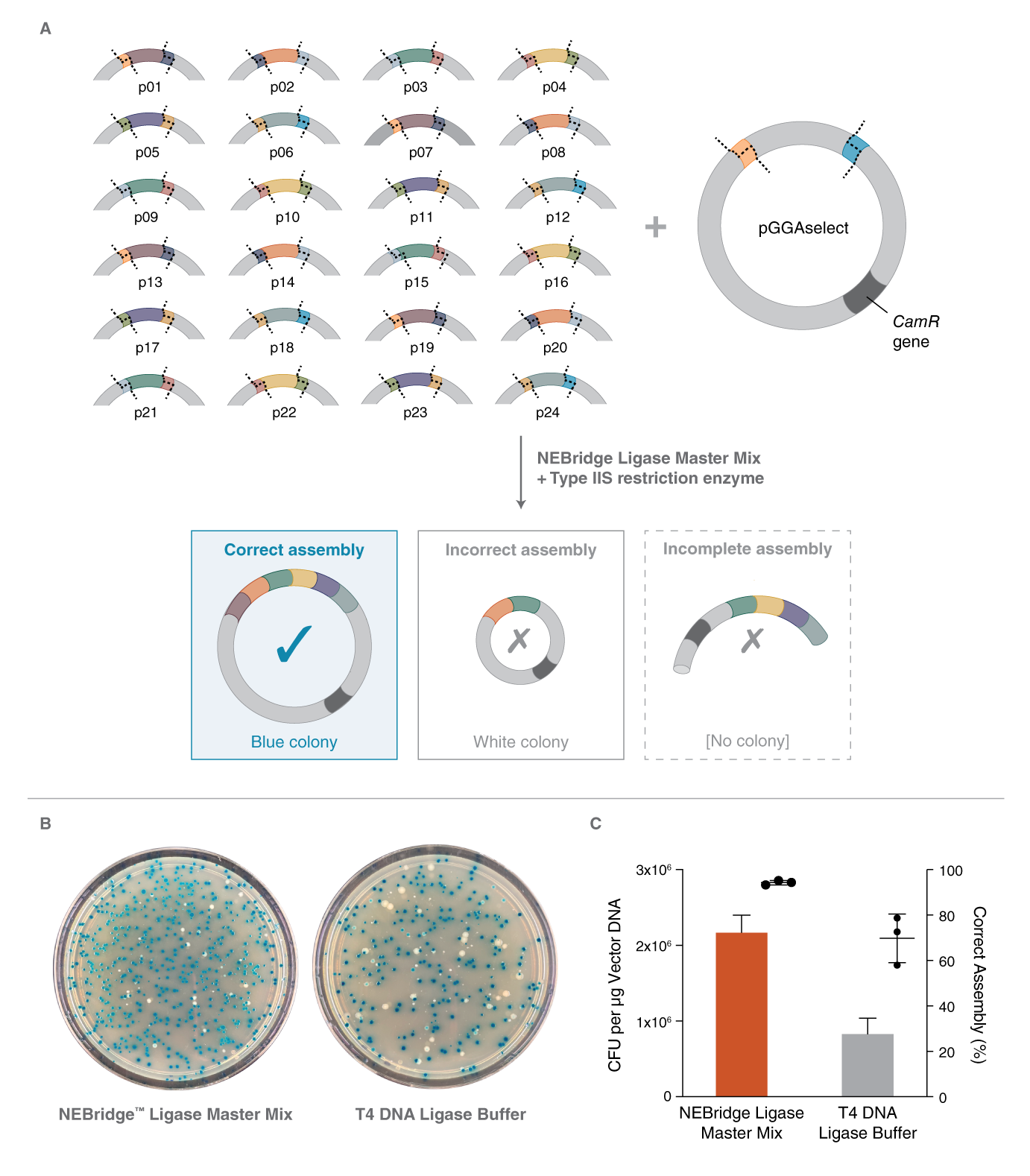
上海金畔生物科技有限公司代理New England Biolabs(NEB)酶试剂全线产品,欢迎访问官网了解更多产品信息和订购。
产品信息
该预混液中的扩增酶 Q5U,是 Q5 超保真 DNA 聚合酶的优化版本,是新型的热稳定 DNA 聚合酶,具有 3´→5´ 核酸外切酶活性,并且融合有 so7d 结构域,提高了持续扩增能力。NEBNext Q5U 预混液是一种基于适体的热启动剂型,方便在室温下建立反应体系。方便的 2X 预混液形式包含 dNTPs、Mg++ 和专利缓冲液,仅需加入引物和 DNA 模板即可进行高效扩增。
NEBNext Q5U 预混液包含在 NEBNext 酶学转化法甲基化建库试剂盒(NEB #E7120)中,并且还适用于重亚硫酸盐测序实验流程中的文库扩增。
- 产品类别:
- Epigenetic Analysis Products,
- Q5® High-Fidelity DNA Polymerases Products,
- Epigenetics Products,
PCR, qPCR & Amplification Technologies Products
- 应用:
- Polymerases for NGS Library Preparation,
- DNA Methylation Analysis,
- Bisulfite Conversion,
- Epigenetics,
Specialty PCR
-
产品组分信息
本产品提供以下试剂或组分:
NEB # 名称 组分货号 储存温度 数量 浓度 -
M0597S -20 NEBNext® Q5U® Master Mix M0597SVIAL -20 1 x 1.25 ml 2 X
-
M0597L -20 NEBNext® Q5U® Master Mix M0597SVIAL -20 5 x 1.25 ml 2 X
-
操作说明、说明书 & 用法
-
操作说明
- Reaction Setup NEBNext® Q5U® Master Mix (NEB #M0597)
FAQs & 问题解决指南
-
FAQs
- Can NEBNext Q5U Master Mix be used to amplify templates containing uracils?
- Is the NEBNext Q5U Master Mix a hot start formulation?
- What cycling conditions should I use for the NEBNext Q5U Master Mix?
- How many cycles of PCR should I perform with the NEBNext Q5U Master Mix?
- Are the DNA products produced by the NEBNext Q5U Master Mix blunt-ended or do they have a single base 3´ overhang?
- Will NEBNext Ultra II Q5 Master Mix incorporate dUTPs?