生物治疗中残留Protein A的检测方法的比较
![]()
人们在过去十年中一直关注着治疗用途的重组人单克隆抗体(rhuMAb IgGs)的开发,其中有数十种抗体已经进入市场。 即使生产一小部分人群所需的治疗用蛋白,也需要使用多种生物加工方法来进行规模化的工业生产,包括重组细胞系的表达系统,层析纯化技术和严格的纯度评估。对纯度的要求包括最小化宿主细胞的蛋白质的浓度和DNA含量为产品的百万分之一或更低。另外,制剂必须是无菌的,确保最终产品中不存在活的微生物,并且没有来自纯化过程中的任何残留污染物。
重组人单克隆抗体通常利用哺乳动物细胞系如中国仓鼠卵巢(CHO)细胞进行大规模生产。纯化通常使用三种柱层析法来满足严格的纯化要求:1)Protein A亲和层析;2)阳离子交换层析(CEX)和阴离子交换层析(AEX)。除此之外,病毒过滤(VF)步骤通常在生产的最后阶段中进行[1]。固定了葡萄球菌Protein A(PA)的树脂对rhuMAb IgGs中存在的可结晶片段(Fc)区域具有高亲和力,能够从宿主细胞的培养基或细胞粗裂解物中捕获目标抗体。虽然这些树脂对于目标蛋白有着高容量和选择性,但是目前已发现痕量的PA配体会对抗体产物产生污染。这些用于生物治疗的药物中残留的PA污染可能会导致免疫原性影响,并且有毒理性和促有丝分裂性影响[2]。因此,寻找一种用于检测和量化痕量PA的可靠、稳健的方法十分重要,并且,美国FDA也对此作出了强制性的要求。
在这里,我们向大家介绍两种用于检测生物治疗药物中残留PA 的方法,分别是兼容高通量筛选(HTS)的自动化均相免疫分析(图1)和常规的ELISA方法(图2)。介绍的内容包括:对残留PA检测下限(LDL)的评估、对抗体组(10个/组)中的人IgG抗体(包括Herceptin®、Rituxan® 和Erbitux® 中的活性治疗成分,曲妥珠单抗、利妥昔单抗和西妥昔单抗)中残留PA的筛查结果的评估。
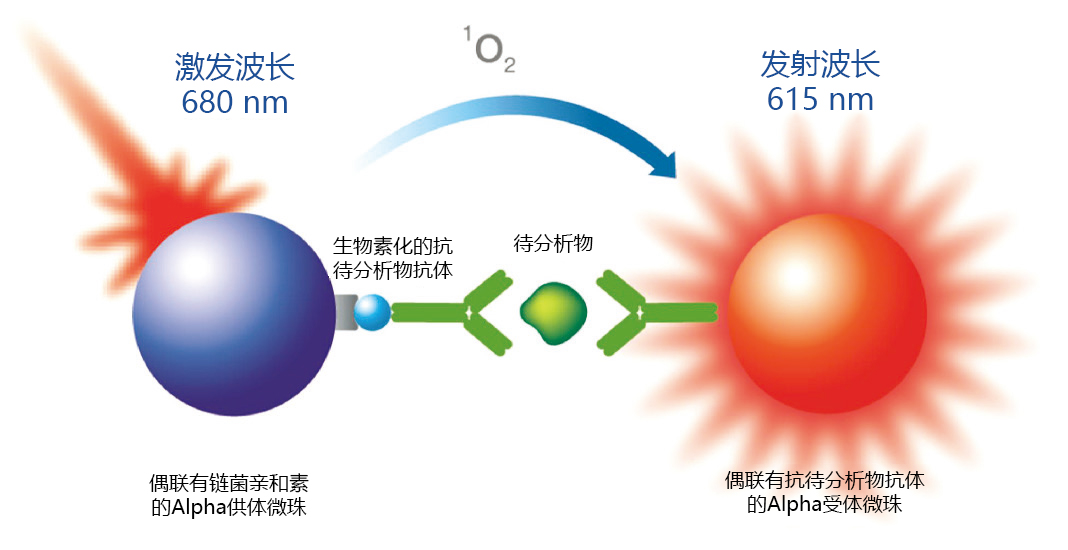
图1. 用于测定生物治疗产品中的待分析物的AlphaLISA均相免疫分析法的测试示意图。
AlphaLISA的供体微珠在被激发光激发后会产生单线态氧分子。通过三明治夹心免疫法,使得受体微珠和供体微珠紧密靠近,单线态氧分子从而在受体微珠中触发能量转移级联反应,并在615nm处出现一个发射峰。
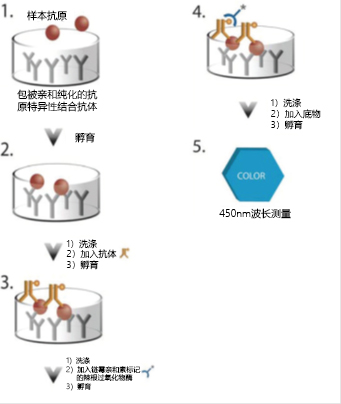
图2. 用于测定生物治疗产品中的待分析物的ELISA分析法的测试示意图。
1. 将样本和标准品加入包被能与Protein A特异性结合的鸡抗体的孔中。将微孔板洗涤,使其仅留下结合后的Protein A。
2. 加入生物素化鸡抗体并与已捕获的Protein A结合。
3. 加入链霉亲和素标记的辣根过氧化物酶(HRP)复合物,使其与生物素化抗体结合。
4. 加入TMB底物,经辣根过氧化物酶催化后即产生蓝色。
◆仪器
Cytation5细胞成像多模式检测仪
Cytation™ 5是一个整合了全自动数字显微镜和传统的微孔板检测仪的可灵活配置,升级的检测系统。Cytation 5同时含有基于过滤器和单色器的光学器件以用于多种功能模式,并提供用于Alpha分析的基于激光的激发功能。
Synergy HTX多功能微孔板检测仪
Synergy™ HTX多功能微孔板检测仪是一款小巧紧凑,高性价比的系统,适用于6至384孔的微孔板和Take3™ 微量板。因为其采用独特的双光学设计,可卓越的完成吸光度,荧光,冷光和AlphaScreen® /AlphaLISA® 的测量。
MultiFlo FX多功能微孔板分液器
MultiFlo™ FX是一种全自动多功能分液器,适用于6至1536孔的微孔板,配备BioTek独特的Parallel Dispense™(平行分装)技术。最多可以平行分装四种独立的试剂,而不会产生潜在的残留。该仪器用于将实验待用的特异性试剂分装到384孔测定板中。
◆实验材料与方法
实验试剂
AlphaLISA残留Protein A试剂盒,购自Perkin Elmer (No. AL287, Waltham, MA, USA)。Protein A ELISA试剂盒由Enzo Life Sciences公司赠送(No.ADI-900-057C, Farmingdale, NY, USA)。
测定用微孔板
AlphaPlate™ -384,灰,不透明,384-孔(No.6005350)微孔板购自PerkinElmer (Waltham, MA, USA)。不含Protein A的384-孔微孔板由Enzo Life Sciences公司赠送(Farmingdale, NY, USA)。
仪器设定
Synerg HTX使用表1和表2中所示的设定,而Cytation 5使用表3中的设定。
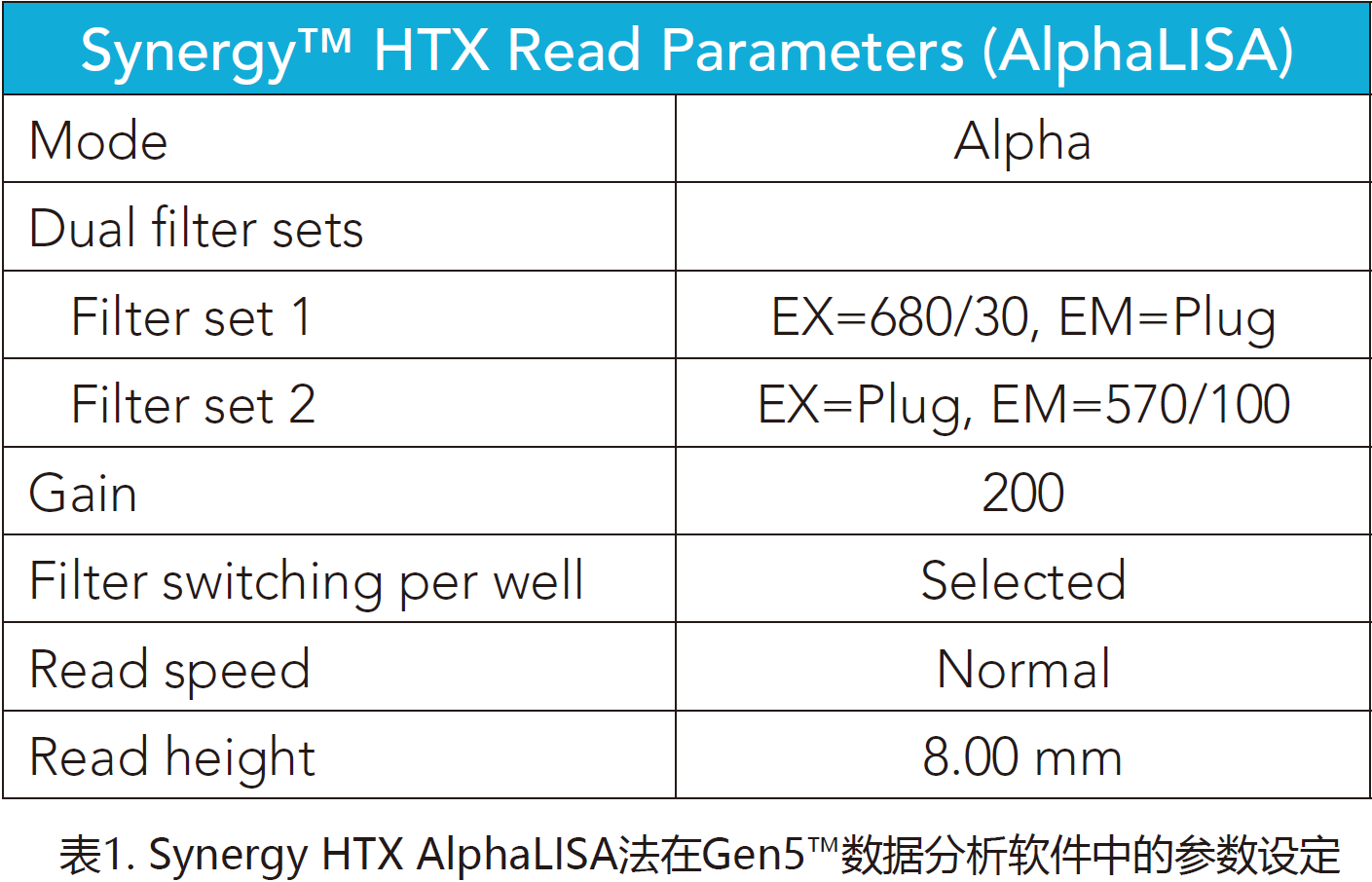
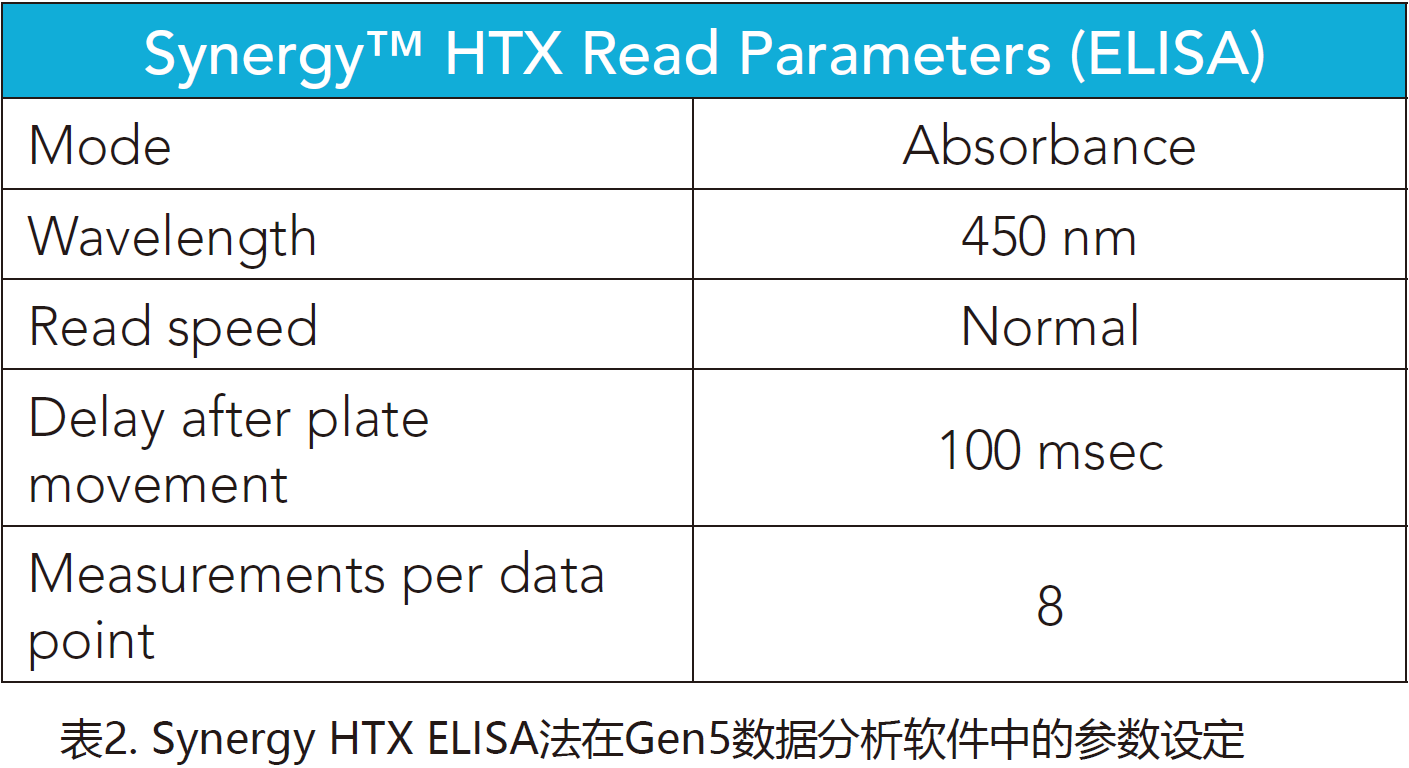
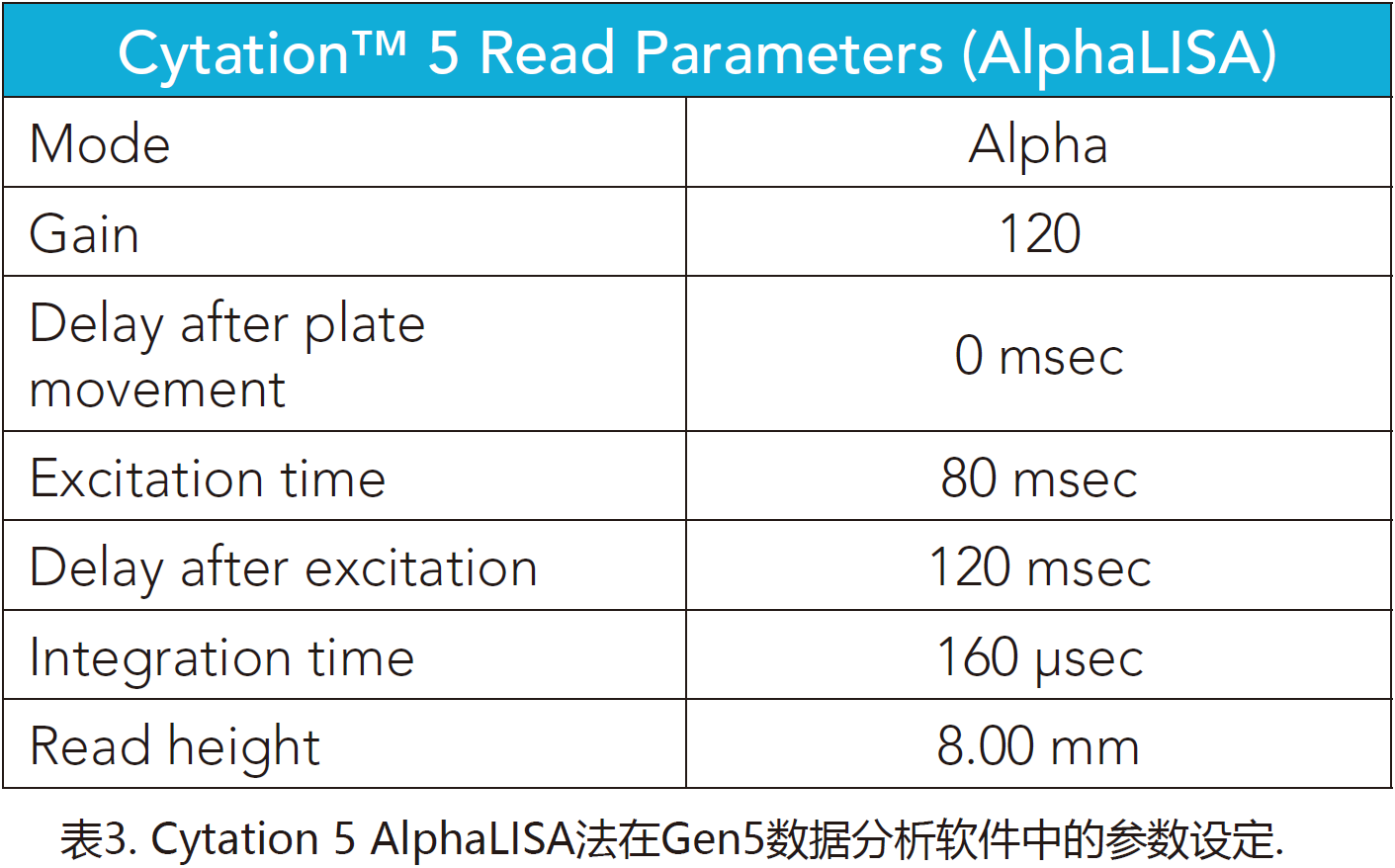
样本准备
按照制造商的建议,分别制备Protein A分析物标准溶液。稀释样本以确保总IgG浓度≤1 mg/ mL。将每种标准品以80 μL转移到微量离心管中,并加入40 μL的3×解离缓冲液。然后将标准品和样本在加热板中98℃加热60分钟。孵育后,将标准品和样品冷却至室温(RT)约5-7分钟,然后200×g离心5分钟。
AlphaLISA® 实验步骤
将四份样本和标准品转移至384孔微孔板(每孔5 μL)。制备2.5×AlphaLISA抗Protein A受体微珠和生物素化抗体抗分析物的混合物,并使用MultiFlo™ FX向每个测定孔中加入20 μL上述混合物。将微孔板置于定轨振荡器上10分钟,然后在室温下孵育共60分钟。新鲜制备2×SA-供体微珠混合物,使用MultiFlo™ FX将25 μL的该混合物加入到每个测定孔中,然后在室温下孵育30分钟,避免光的直射。在经过最后的孵育后,用仪器对微孔板进行读数。
ELISA实验步骤
将四份样本和标准品(各25 μL)转移至微孔板的每个孔中,以500 rpm在混合器上室温孵育60分钟。然后使用MultiFlo FX洗涤4次,每次100 μL洗涤液。将25 μL生物素化的抗Protein A抗体加入除空白组以外的孔中,以500 rpm在混合器上室温孵育60分钟。在如上所述洗涤微孔板后,向除空白组以外的所有孔中加入25 μL链霉抗生物素蛋白标记的辣根过氧化物酶(HRP)溶液,并将孔板以500 rpm在混合器上室温孵育30分钟。如上所述洗涤微孔板并加入25 μL底物溶液。将微孔板在室温下摇晃混匀并孵育15分钟。向每个孔中加入15 μL终止液以终止反应,并在酶标仪上读数。
◆结果与讨论
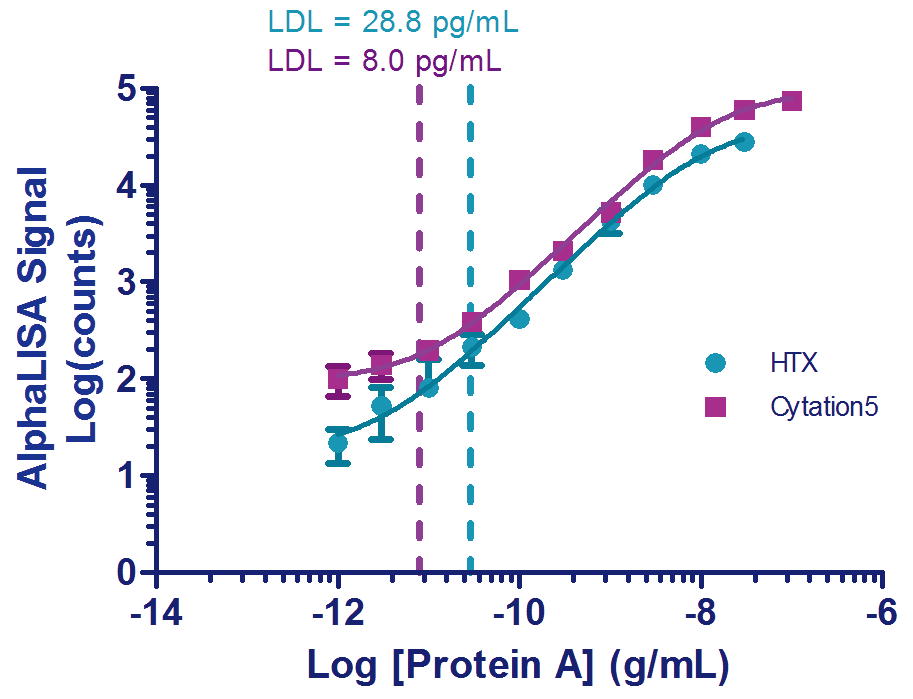
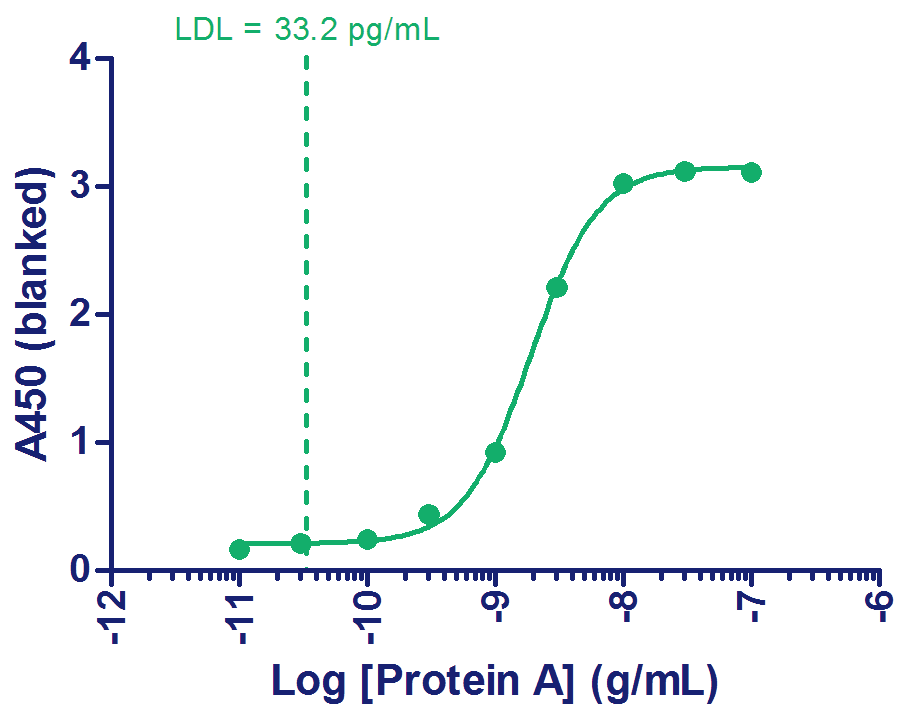
Protein A标准曲线
为每次实验准备了跨度10个/组的6组标准曲线,Protein A标准品由生产商提供。 这些用于优化CytationTM 5和SynergyTM HTX仪器参数(表1-3)设定并在进行测定时确定样品浓度。从图3中可以看出,可以使用4参数的逻辑方程并以1 / Y2进行加权来拟合数据。为了确定检测下限(LDL),AlphaLISA或ELISA法分别需要测定重复四次(共12个数据点)或16个重复的3个背景值。检测下限可以通过将背景值的平均值(12或16个孔在非测量时的背景值)+ 3×标准偏差值(平均背景值+(3×标准差))计算所得的值代入到标准曲线来计算得出(图3a和3b)。
|
|
|
| A |
B |
图3. Protein A标准曲线。
A)AlphaLISA测定Protein A。制备12个稀释系列的数据点用于阳性对照,其范围为100,000-0.3 pg/mL。通过12个背景值来计算LDL。
B)ELISA测定Protein A。制备9个稀释系列的数据点用于阳性对照,其范围为100,000-10 pg/mL。通过12个背景值来计算LDL。
如图3a中几乎平行的两条标准曲线所示,AlphaLISA分析显示了仪器之间极好的相关性。在其他相同的测定条件下,配备了Alpha激光的Cytation 5会显著产生更高约2倍的信号(图3a)。当在较低的浓度时使用Synergy HTX读取时,重复实验所得的数据点的差异会有所增加,导致LDL有着大于3倍的增加,LDL为29 pg / mL,而使用Cytation 5的LDL为8.0 pg / mL(图3a)。不过ELISA测定在重复实验中有着极好的相关性,计算所得的LDL约为33 pg / mL(图3b)。正如制造商所述,所有决定因素与已确定的实验性能特征有着很好的相关性
残留Protein A的抗体组筛查实验
对于10个/组的人IgG抗体,包括用于治疗的曲妥珠单抗,利妥昔单抗和西妥昔单抗中的残留PA的存在进行检测。虽然大多数抗体能以非常高的浓度在溶液中稳定存在,但当抗体浓度高于1.0 mg / mL时,会干扰测定的性能,因此要在分析之前稀释所有样品。在确定每个样品的信号后,根据标准曲线计算出残留PA的浓度。然后根据合适的稀释因子计算抗体储备液中残留PA的实际浓度(表4)。
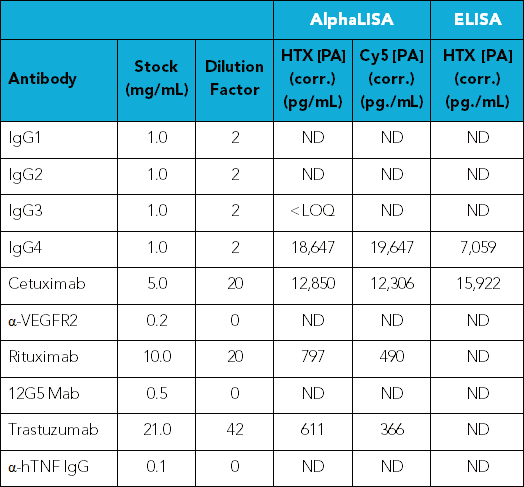
表4. 用于筛查残留Protein A的抗体组。
将抗体从储备液取出并稀释至<1 mg / mL,每个样本重复四次。
按照标准曲线可计算出残留PA浓度。
通过乘以适当的稀释因子即可算出抗体储备液中PA的实际浓度。
如表4所示,在抗体组测试中,几种抗体显示出明显的残留PA,包括IgG4和治疗用的西妥昔单抗。当使用AlphaLISA测定法分析时,还发现利妥昔单抗和曲妥珠单抗可检测出PA,但使用ELISA测定时则检测不到。其他抗体的PA水平低于每种仪器和方法的检测下限。图4按污染百分比绘制出不同抗体的PA的可检出水平。
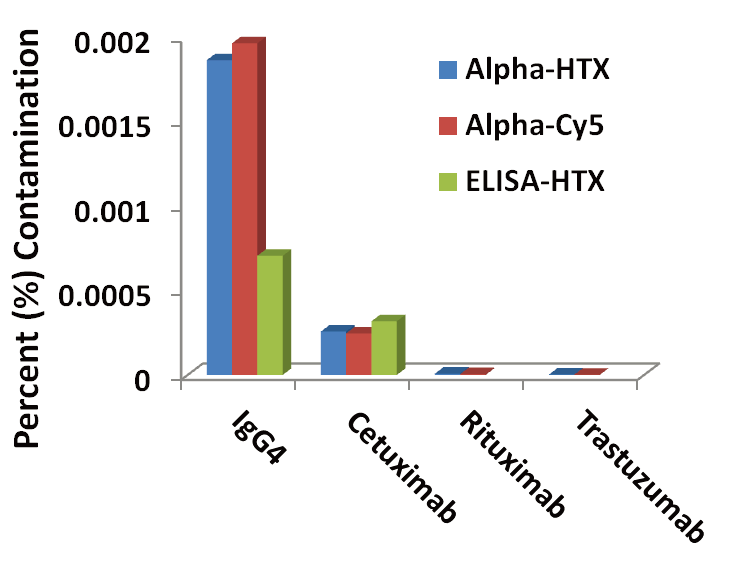
图4. 人抗体组的残留Protein A的筛查。
10个/组可检出Protein A的人抗体。图4仅列出能够对Protein A进行定量的抗体。
◆结论
本实验使用自动分液器进行试剂分装,用兼容HTS的384孔微孔板法进行测定。低水平污染的测出表明两种测定方法都具有出色的灵敏度。使用AlphaLISA残留Protein A试剂盒和ELISA试剂盒检测残留PA,皆表现出良好的相关性。配备了Alpha特异性激光的Cytation 5产生的信号比Synergy HTX更高,分析时间更快,并且有着更低的检测下限,适用于高通量筛选。相反,Synergy HTX是采取非高通量筛选下的更经济实惠选择。Synergy HTX结合了更高的密度的384孔ELISA格式,与标准的96孔ELISA格式相比,这种的成本更低,通量更高。
◆产品列表
| 产品编号 | 产品名称 | 包装 |
| ADI-900-057 | Protein A ELISA kit 蛋白A酶联免疫试剂盒 |
96 wells |
◆参考文献
|
1. |
Mehta, A., et al. 2007. Purifying Therapeutic Monoclonal Antibodies. CEP. SBE Special Section: Bioprocessing. S14-S20. |
|
2. |
Zhu-Shimoni, J.; Gunawan, F.; Thomas, A.; Vanderlaan, M.; Stults, J. 2009. Trace level analysis of leached Protein A in bioprocess samples without interference from the large excess of rhMAb IgG. J. Immunol. Methods, 341 (1-2), pp. 59–67. |
本文中的“Alpha”指的是PerkinElmer公司的带有商标和注册商标的产品和技术。