上海金畔生物科技有限公司代理New England Biolabs(NEB)酶试剂全线产品,欢迎访问官网了解更多产品信息和订购。
产品信息


Taq 高保真 DNA 连接酶是经过优化的混合物,由热稳定 DNA 连接酶和专有添加剂组成,能以优异的保真度高效地连接 DNA 切刻位点。在优化的反应缓冲液中,该酶能够催化磷酸二酯键形成,使得与同一互补靶标 DNA 链杂交的两条相邻寡核苷酸链的 5´ 磷酸末端和 3´ 羟基末端通过磷酸二酯键相连,极大程度减少了错配连接(1)。改良的配方使得该产品可以更好地识别连接反应供体和受体,从而能够精确检测 SNP 和其它等位基因变异。Taq 高保真 DNA 连接酶在高温(37 – 75℃)范围内都具有活性(2,3)。
请注意,Taq 高保真 DNA 连接酶适用于依赖高保真切刻连接的分子诊断应用。该酶不能替代 T4 DNA 连接酶,不适用于克隆应用或接头连接/NGS 文库制备。
图 1:Taq 高保真 DNA 连接酶表现出更佳的保真度
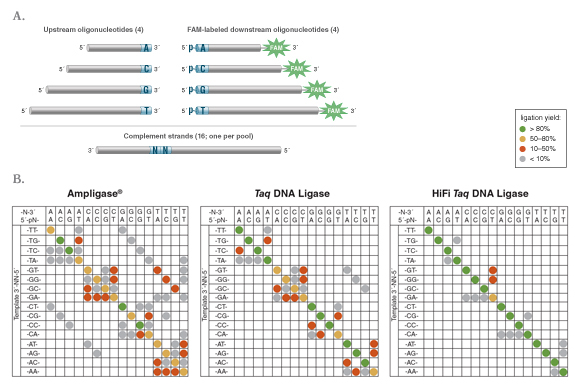
图 2:Taq 高保真 DNA 连接酶表现出更强的双端错配连接识别能力
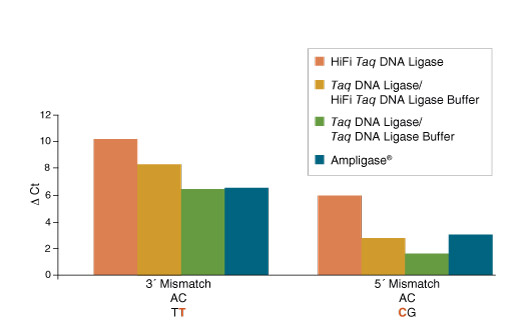
图 3:Taq 高保真 DNA 连接酶表现出更佳的热稳定性
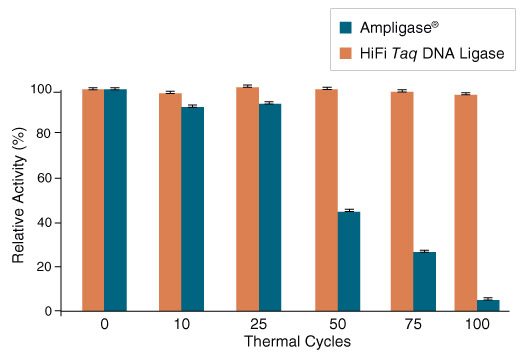
图 4:Taq 高保真 DNA 连接酶的连接错配率是 Ampligase 的 1/2
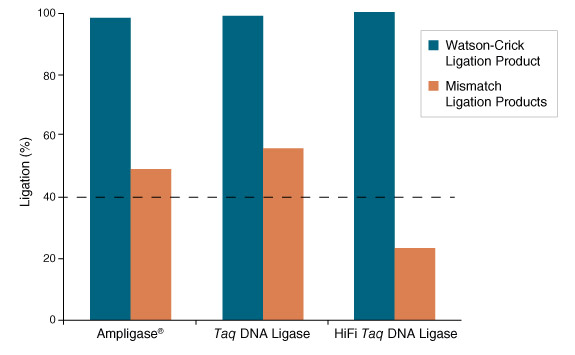
产品来源
从大肠杆菌菌株中纯化获得,携带有克隆自极度嗜热生物的连接酶基因。
- 产品类别:
- DNA Ligases Products
- 应用:
- Non-Cloning Ligation,
- DNA Ligation
-
产品组分信息
本产品提供以下试剂或组分:
NEB # 名称 组分货号 储存温度 数量 浓度 -
M0647S -20 HiFi Taq DNA Ligase M0647SVIAL -20 1 x 0.05 ml 50 reactions HiFi Taq DNA Ligase Reaction Buffer B0647SVIAL -20 1 x 0.5 ml 10 X
-
-
特性和用法
反应条件
1X Taq 高保真 DNA 连接酶反应缓冲液
1X Taq 高保真 DNA 连接酶反应缓冲液
20 mM Tris-HCl
150 mM KCl
10 mM MgCl2
10 mM DTT
1 mM NAD
0.1% Triton® X-100
(pH 8.5 @ 25°C)贮存溶液
10 mM Tris-HCl
100 mM KCl
1 mM DTT
0.1 mM EDTA
0.1% Triton® X-100
50% Glycerol
pH 7.4 @ 25°C热失活
否
-
优势和特性
应用特性
使用连接酶检测反应(LDR)、连接酶链式反应(LCR)(2,4)进行等位基因特异性基因检测。锁式探针连接反应(5)等依赖连接酶的方法。
-
相关产品
相关产品
- Taq DNA 连接酶
- 9°N™ DNA 连接酶
-
注意事项
- 反应条件:Taq 高保真 DNA 连接酶的反应温度范围为 37 – 75℃。对于某组给定的探针,最佳连接温育温度通常与探针退火区域 Tm 值相差 5℃ 以内。同时在实际应用中,需要根据经验实现活性和保真度的最佳平衡。强烈推荐使用 Thermostable Ligase Reaction Temp Calculator 来计算温育温度。对于经典的 LDR 检测,反应时间通常在 10 – 60 分钟之间,其中 15 分钟反应时间适用于多数应用。对于需要进行变性/退火/连接循环的检测,我们建议在 95℃ 条件下变性 30 s – 1 min,然后以探针组优化后的连接温度退火/连接 1 – 5 分钟。
- 1X Taq 高保真 DNA 连接酶反应缓冲液中需要 NAD+ 作为辅因子。10X Taq 高保真 DNA 连接酶反应缓冲液中已含有 NAD+。虽然 10X Taq 高保真 DNA 连接酶缓冲液在 -20℃ 条件下可稳定储存 3 年,但应将反应缓冲液储存在 -80℃ 条件下,以便进一步延长 NAD+ 辅因子的半衰期。
- 若需稀释Taq 高保真 DNA 连接酶,之后 -20℃ 贮存,可使用含 50% 甘油的贮存缓冲液(稀释液 A,NEB #B8001),但稀释后的 Taq 高保真 DNA 连接酶的保质期将缩短。如果稀释后立即使用,也可使用 1X Taq 高保真 DNA 连接酶反应缓冲液进行稀释。
- 为使 Taq 高保真 DNA 连接酶实现最高保真度,建议配合使用 Taq 高保真 DNA 连接酶反应缓冲液;不过,Taq 高保真 DNA 连接酶也可用 Taq DNA 连接酶反应缓冲液,但酶的活性和保真度会有所下降。相反,如在 Taq 高保真 DNA 连接酶反应缓冲液中使用标准 Taq DNA 连接酶,将提升该酶的保真度。补充 1mM NAD 后,Taq 高保真 DNA 连接酶在多种聚合酶缓冲液中都具有活性,但酶的活性和保真度都将下降。
- 在通过凝胶电泳观察连接反应时,可发现某些 DNA 序列可能会因蛋白组分结合而发生凝胶迁移。这种蛋白结合作用不会影响包括扩增在内的绝大多数下游应用。我们建议在凝胶上样之前,使用蛋白酶 K 进行预处理:在 50 μl 连接反应体系中加入 1 μl 蛋白酶 K,37℃ 温育 30 分钟,以避免出现凝胶迁移。
- 该连接酶的摩尔浓度为 44 nM。
-
参考文献
- Lohman, G. et al. (2016). Nucleic Acids Res. DOI: 0.1093/nar/gkv898 PubMedID: 44(2):e14
- Barany, F. (1991). Proc. Natl. Acad. Sci. USA. 88, 189-193.
- Takahashi, M. et al. (1984). J. Biol. Chem. 259, 10041-10047.
- Barany, F. (1991). The Ligase Chain Reaction in a PCR World. 5-16.
- Nilsson, M., H. Malmgren, M. Samiotaki, M. Kwiatkowski, B. P. Chowdhary and U. Landegren (1994). Padlock probes: circularizing oligonucleotides for localized DNA detection.. Science. 265(5181), 2085-2088.
操作说明、说明书 & 用法
-
操作说明
- HiFi Taq DNA Ligase (M0647) Protocol
工具 & 资源
-
选择指南
- DNA Ligase Selection Chart
- Properties of DNA and RNA Ligases
-
Web 工具
- NEBcloner®
- NEBioCalculator®
- Thermostable Ligase Reaction Temperature Calculator
FAQs & 问题解决指南
-
FAQs
- What applications are HiFi Taq DNA Ligase best used for?
- Can HiFi Taq DNA Ligase buffer be used with other DNA ligases?
- Can HiFi Taq DNA Ligase be used in other buffers?
- What is the optimal reaction temperature for HiFi Taq DNA Ligase?
- How much HiFi Taq DNA Ligase is required for a reaction?
- How many temperature cycles will HiFi Taq DNA Ligase survive?
- Can HiFi Taq DNA Ligase be used for cloning?
- Does HiFi Taq DNA Ligase require NAD+?
- What is the stability of HiFi Taq DNA Ligase at 95°C?
- What is the stability of HiFi Taq DNA Ligase at room temperature?
- Why is the HiFi Taq DNA Ligase Buffer brown?
- Do thermostable DNA ligases (such as Taq DNA Ligase, 9°N DNA Ligase, and HiFi Taq DNA Ligase) ligate sticky ends?
- Does HiFi Taq DNA Ligase have activity on substrates containing RNA?
- What is LDR and how does it differ from LCR?
- What is LCR and which enzymes do you recommend?
- How can I design probes for LDR or LCR to maximize specificity?
